校正試験点、公差、頻度をどのように決定していますか?単純な経験則では、フルスケール・レンジの10、50、90%で機器を校正し、メーカー公差の1.5倍または2倍の公差を使用します。多くの企業では、重要な計器は半年に1回、重要でない計器は年に1回校正するよう、校正頻度を標準化しています。この方法では、新しい機器を校正プログラムに導入し、校正スケジュールを管理することは容易かもしれませんが、余分な作業が発生し、時間とコストがかかる可能性があります。
この記事では、国際製薬技術者協会(ISPE)の適正製造規範(GAMP)ガイドを使用して、校正範囲、許容範囲、頻度、重要度を決定するためのリスクベースのアプローチと、実施に使用できるヒントやツールについて説明します。ISPE GAMPガイドに従うことで、キャリブレーション・プログラムが、21世紀の適正製造基準(GMP)に対するリスクベースのアプローチという食品医薬品局(FDA)の推進するイニシアティブに適合することが保証されます。このアプローチは、製品の品質と公共の安全に対するリスクに集中的に焦点を当てるもので、多くの場合、組織にコスト削減をもたらします。
このようなプログラムのバックボーンは、信頼性が高く、正確で、追跡可能な情報に基づいて、正しい意思決定を行うことにかかっている。必要な情報は、ユーザー要求事項仕様書(URS)、バリデーションプロトコル、その他製造工程開発時に作成され承認された文書に記載されている。これらの文書は、以下の決定に基づいてFDAの要求事項を満たすために使用される:
- その医薬品が提案された用途において安全かつ有効であるかどうか、また、その医薬品のベネフィットがリスクを上回るかどうか。
- 提案されている医薬品の添付文書が適切かどうか、またその内容はどうあるべきか。
- 医薬品の製造に使用される方法および医薬品の品質を維持するために使用される管理が、医薬品の同一性、強度、品質および純度を維持するために適切であるかどうか。
Cオンプレットイング リスクアセスメント の 楽器 を使用している。 上記 書類 意志 決める その クリティカリティ、 校正頻度, テストポイント 寛容s 科学的データに基づく, 経験則や当て推量ではない. It also helps 確保リソース リソースが集中させる 施設の最も重要なエリアに最大限の 利用率そして 削減eコストを削減する。
最初のステップは、リスクアセスメントを実施するチームを編成することである:
- プロセス/システムエンジニア – パラメータと限界値、プロセスにおける重要なステップ、プロセスの許容誤差を特定する。また、校正仕様と校正頻度の承認、リスクアセスメントの承認も担当します。
- 校正/計量スペシャリスト – リスク評価プロセスの開始と管理、校正仕様と校正頻度の策定、プロセス要件を満たす適切な機器の選択と承認、校正戦略の設定、リスク評価の承認。
- 品質保証 – プロセスパラメータとリミットが規制当局の提出基準に適合していることを確認し、校正仕様と校正頻度をレビューし、サイトの手順に準拠していることを確認し、リスクアセスメントの最終承認を行う。
チーム編成を終えて ダウンロード レポート あなたの コンピュータ メンテナンス M管理システム (けいえいじょうほうかんりシステム) その を含む。 楽器 プロセスまたはシステムの 評価する. 報告書に以下の内容が含まれていると便利である。 インフォメーション 対して プロセス/システム内の測定場所その のメーカーとモデル番号 設置済み 楽器がある、 そして 現在の校正仕様. リスク評価 プロセスs いくつかの質問に答えることも含まれる への 決める その 正しい校正 プロセス限界, および周波数. 以下は リスク評価プロセスの概要
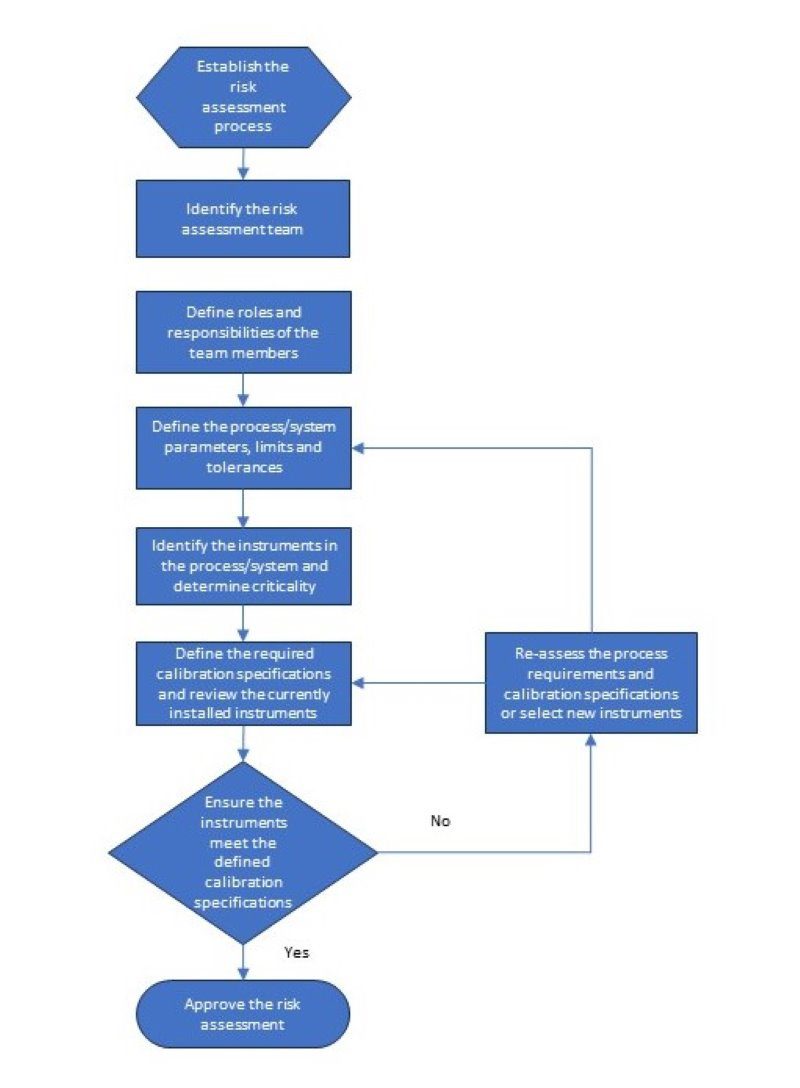
リスクアセスメントをどのように完了すべきか、また、どのような情報が必要であ るかについて詳述したSOPを作成すべきである。以下は、リスクアセスメントを完了するために必要な情報のリストとアセスメントプロセスの例である。
- 楽器ID
- 楽器説明
- 機器メーカー、モデル、シリアル番号
- 測定範囲と精度
- 設置されているシステム/プロセス
- プロセス範囲、動作範囲、公差
- 機器の臨界
- 校正範囲、テストポイント、許容差
- 校正周波数
- リスク評価チームメンバーの署名
上記の情報のほとんどは、設置された機器とプロセス文書から得られます。校正の仕様は、以下のような質問に答えることによって決定されます。
- 計器の重要性(影響評価によって事前に決定されている可能性がある):
- 器具の洗浄や滅菌に使用されていますか?
- 失敗が製品の品質や患者の安全に影響を与えるか?
- 失敗がプロセスの有効性やその他のビジネス面に影響を与えるか?
- 障害が発生した場合、安全面や環境面に影響が出るか?
上記の質問のいずれかに「はい」と答えた場合、その測定器はクリティカルに分類される。すべての質問に対する答えが「いいえ」であった場合、その測定器はノンクリティカルに分類される。
- 校正レンジ:動作レンジ内の精度を確保するため、プロセス・レンジまたはアラーム・レンジ(該当する場合)よりわずかに広くする。動作レンジが定義されていない場合、または不明な場合は、装置の全レンジを校正することを推奨する。
- 校正試験点は、校正レンジの下限と上限を設定し、動作レンジ内に少なくとも1点を含める。
- 校正公差は、メーカーの精度より大きく、プロセスの公差より小さくする。
- 校正頻度は、以下のようなリスク要因に基づくことがある:
-
- 故障が発生した場合、製品リリースへの影響は?
- 故障が発生した場合、御社はどれだけの製品の手直しを受け入れることができるでしょうか?
- もし失敗した場合、御社はどの程度の環境影響を受け入れることができますか?
- 同じメーカー、同じモデルの測定器の過去のデータが現地にありますか?
このような作業を通じて、機器は動作範囲全体を通して精度と精度が向上し、機器がプロセスにどのような影響を与えるかについて文書化された根拠があるため、許容範囲外の調査を完了することが容易になります。さらに、ほとんどの企業では、重要な計器の一部(ほとんどではないにしても)は6ヶ月ごとに校正する必要はないと判断しています。また、重要でない機器の校正頻度を18~24ヶ月に延長することを選択する企業もあります。校正頻度を延長するために使用されるもう一つの方法は、過去のデータを使用することです。この場合、最初の校正頻度が設定され、3回目の校正が完了した後にデータの見直しが行われます。装置が調整なしで3回すべての校正に合格した場合、校正頻度を50%または100%延長することができます。下記は校正頻度を延長する例です。
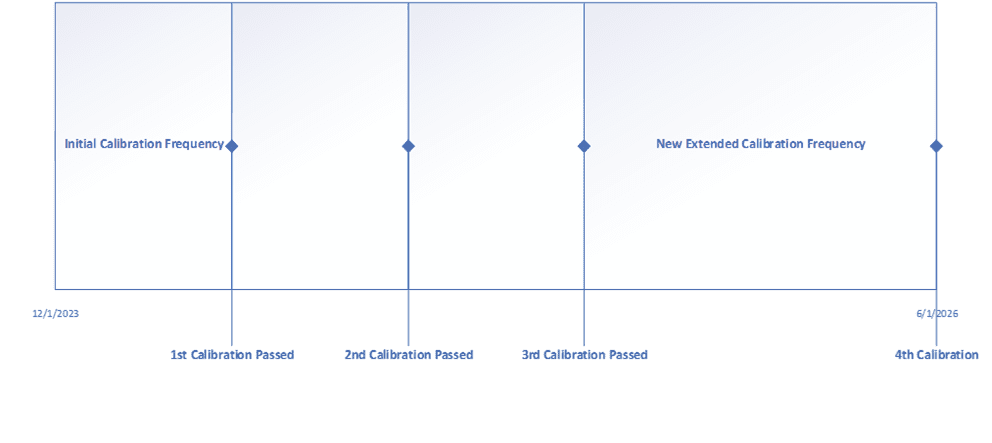
校正の頻度を増やすことは、コスト削減が最も顕著になるところです。年間を通して校正の回数が減るということは、リソースが他の活動を行うことができるということだからです。重要なことは、校正頻度を規定する既存の手順を更新することです。
校正にリスクベースのアプローチを導入することで、お客様の組織に利益がもたらされるのであれば、CAIがお手伝いいたします。CAIは、バリデーション、品質、ヒューマン・パフォーマンス、プロジェクト管理、保守・校正の分野で、部門横断的な経験を持っています。GMP資産管理の信頼できるパートナーとして、ぜひ当社をご利用ください。
